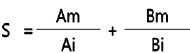This study was initiated to quantitatively evaluate the effects of five heavy metals on the growth and P removal efficiencies of
IC50 (half of inhibition concentration of bacterial growth) and EC50 (half of effective concentration of phosphorus removal Efficiencies) were used to quantitatively evaluate the effects of heavy metals on the growth and phosphorus removal Efficiencies of
Based on the results obtained from this study, it appears that they could provide the basic information about the toxic effects of the respective treatments of single and binary mixtures of heavy metals on the growth and P removal efficiencies of
생활하수, 축산 및 산업 폐수를 비롯한 기타 오염원 내의 다량의 영양염류가 하천 및 호소로 유입되는 경우, 수중 조류의 과다번식이 발생하게 된다. 이로 인해 수질은 악취가 나고 병원성 세균이 번식하게 될 뿐 아니라 수중 용존산소(DO) 또한 고갈된다. 이러한 현상을 부영양화라 하고, 이는 결과적으로 수생태계에 악영향을 주며 수질오염을 발생시킨다(Grady
생물학적 인 제거 공정은 세포 내에 다중 인산염의 형태로 다량의 인을 저장할 수 있는 것으로 알려진 인염 축적균(Phosphorus Accumulating Organisms, PAOs)(Sedlak, 1991; Zuthi
따라서 본 연구는 인을 축적하는 능력을 가진 미생물(Phosphate Accumulating Organisms, PAOs)로 알려진
본 연구에 사용된 미생물은 한국생명공학연구원 생물자원센터(Korean Collection for Type Cultures, KCTC)에서 분양받은
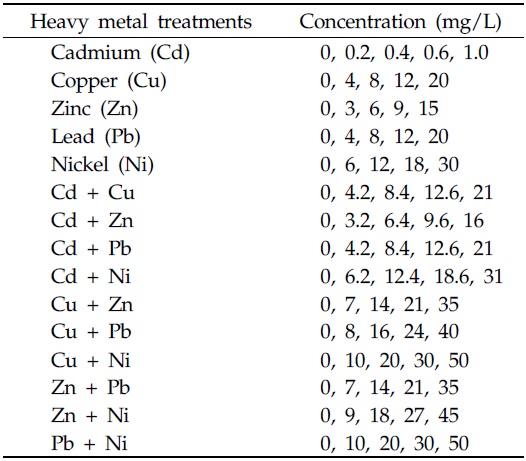
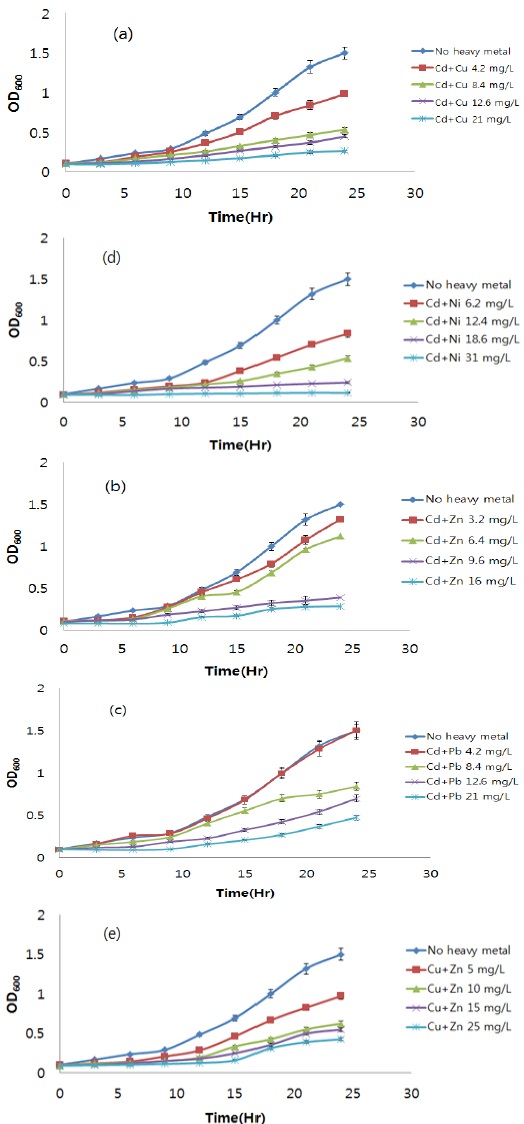
처리구의 설정은 실험배지에 균주를 처리하지 않은 blank, 배지에 균주만 처리한 대조구, 단일 및 2종 중금속을 중금속 별로 4개의 농도로 처리한 중금속 처리구로 하였다. 실험에 사용된 중금속 표준용액은 Cd standard solution, Cu standard solution, Zn standard solution, Pb standard solution, Ni standard solution (1,000mg/kg, Kanto chemical Co., Japan)을 사용하였으며, 처리한 중금속 별 처리농도는 Table 1 과 같다. 실험배지에 포함된 2종 중금속은 단일 중금속 처리 시 포함된 양과 동일하게 하였다. Table 1의 농도는 중금속 2종의 합으로 표기하였다.
[Table 1.] Treatments of single heavy metals and concentrations
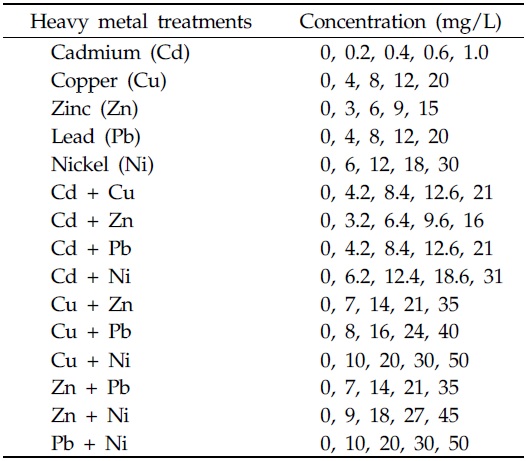
Treatments of single heavy metals and concentrations
실험 배지에서 균의 생육도 측정은 균주가 포함된 배지의 Optical Density (OD) 를 이용하여 실시하였다. OD 측정을 위한 배양액은 멸균 syringe 를 이용하여 채취하였다. 채취한 시료는 분광광도계(Model UV Mini 1240 Shimadzu, Kyoto, Japan)를 이용하여 600 nm 의 파장에서 3 시간마다 1회 흡광도를 측정하였으며, 배지 내 총 인 농도는 ascorbic acid에 의한 몰리브덴 청법을 변형하여 측정하였다(Kim, 2012). 분광광도계(Model UV Mini 1240 Shimadzu, Kyoto, Japan)를 이용하여 880 nm의 파장에서 흡광도를 측정하였으며, 초기 및 최종 인 농도의 비교를 통해 단일 미생물 및 혼합 미생물 처리구 간 인 제거 효율을 비교 분석하였다.
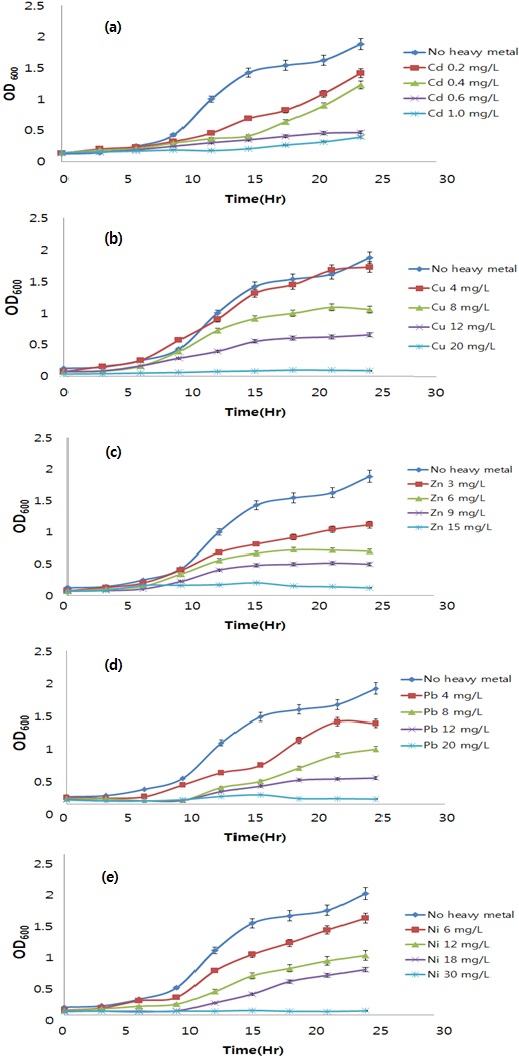
반수 생장 저해 농도(half of inhibition concentration of bacterial growth, IC50) 및 반수 인 제거 효율 저해 농도(half of effective concentration of phosphorus removal efficiencies, EC50)의 계산은 흡광도 값에 자연로그를 취한값을 시간별로 최소 제곱 추정에 의해 나타나는 선형 회귀식을 이용하였다. 반수치사농도인 IC50를 추정하기 위한 Log gamma 분포는 생장저해 결과를 회귀 분석하여 결정하였고 (Asami
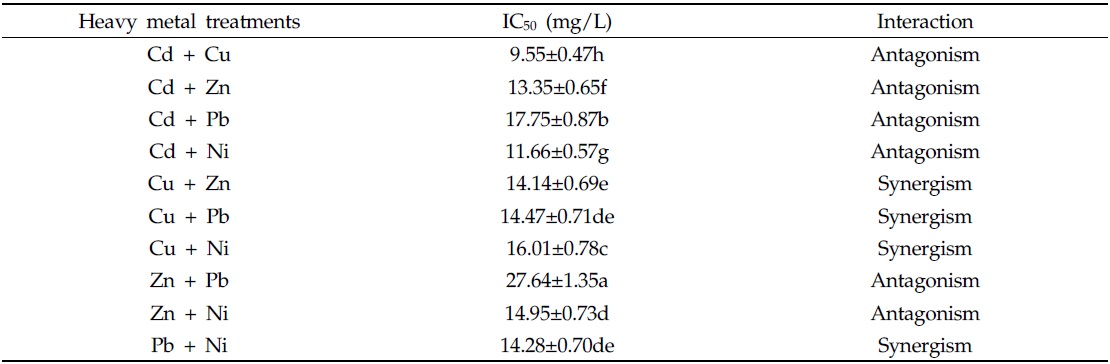
중금속 혼합 처리 시, 중금속 간 교호작용을 확인하기 위해 additive toxicity index method(Marking and Mauck, 1975)를 이용하였다. Additive toxicity index method는 각각의 화학물질의 IC50 및 EC50 값과 혼합되었을 때의 IC50 및 EC50 값을 구해 이를 이용하여 혼합물질의 독성에 대한 각각 화학물질의 기여도를 평가하는 방법으로 계산식은 아래와 같다.
위의 식에서 계산한 S값을 이용하여 2종의 중금속 간 상관관계를 AI(Additive Index value)값을 기준으로 하여 평가할 수 있다. S 값이 1 보다 작을 경우, AI 계산은 1/S-1.0 으로, S 값이 1보다 큰 경우, –S+1.0, S 값이 1일 경우 S-1(=0) 으로 계산한다. AI값 계산결과가 0보다 크면 중금속간 상승적 상호작용(synergistic interaction), 0보다 작으면 길항적 상호작용(antagonistic interaction) 으로, AI값이 0일 경우 상가적 상호작용(additive interaction)으로 판단할 수 있다(Lange and Thomulka, 1997).
실험 결과의 통계분석은 SAS software package version 9.1 (SAS Institute, Cary, North Carolina, USA)를 이용하여 실시하였다. 실험결과의 유의한 차이를 조사하기 위해 ANOVA(analysis of variance) 분석과 Tukey’s HSD(honest significant difference) test를 실시하였으며, 신뢰구간은 95% 수준으로 설정하였다. 모든 실험은 3반복 실시되었다.
[Table 2.] IC50 of Alcaligenes sp. with single heavy metal treatments

IC50 of Alcaligenes sp. with single heavy metal treatments
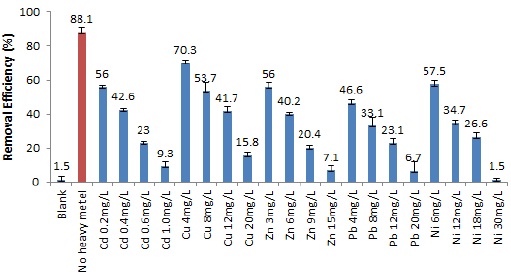
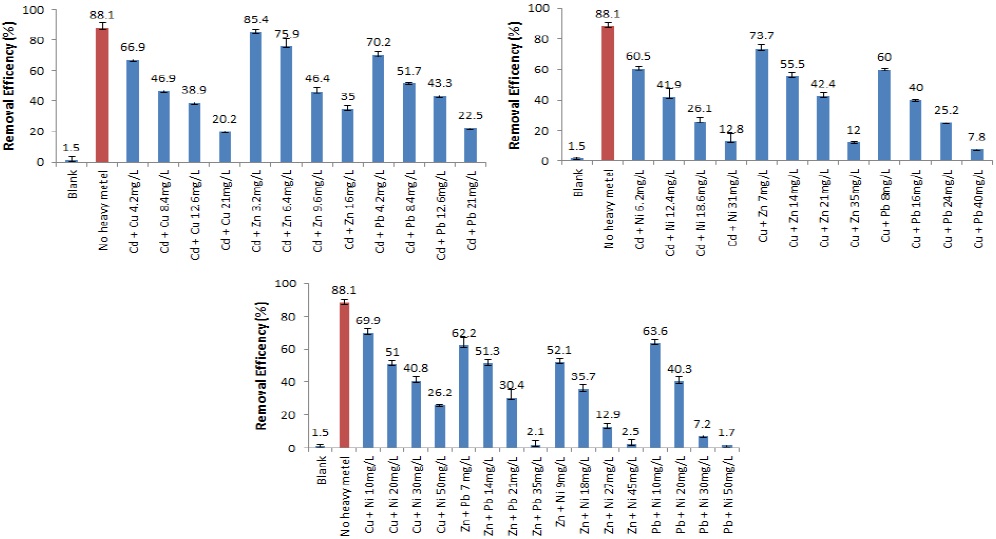
중금속이 균주의 인 제거에 미치는 영향을 확인하기 위해 초기 인 농도와 최종 인 농도를 측정하였으며, 각각의 중금속 처리구 별 인 제거율은 Fig. 2 와 같다. 인 제거효율 또한 처리한 중금속의 종류에 관계없이 중금속 처리 농도가 증가할 수록 감소하는 경향을 보였다. 인 제거효율은 미생물만을 처리한 대조구에서 가장 높았으며, 처리구별 인 제거 효율을 이용하여 중금속 처리농도에 따른 인 제거 저해효과를 평가하였다. 평가 결과, 카드뮴 처리구의 인 제거효율은 대조구에 비해 각각 37.4%, 51.6%, 73.8%, 89.4% 감소한 것을 확인할 수 있었다. 구리 처리구는 대조구에 비해 인 제거효율이 각각 20.3%, 39.1%, 52.6%, 82.1% 감소하였고, 아연 처리구의 경우, 대조구에 비해 인 제거효율이 36.4%, 54.4%, 76.8%, 92.0% 감소한 것을 확인할 수 있었다. 납 처리구에서는 대조구에 비해 인 제거효율이 47.1%, 62.4%, 73.8%, 92.4% 감소한 것을 확인할 수 있었으며, 니켈 처리구는 대조구에 비해 인 제거효율이 각각 34.6%, 60.6%, 69.7%, 98.3% 감소한 것을 확인할 수 있었다. 중금속 처리에 따른 인 제거효율의 저해효과를 기초로 하여
[Table 3.] EC50 of Alcaligenes sp. with single heavy metal treatments

EC50 of Alcaligenes sp. with single heavy metal treatments
2종류의 중금속을 처리하였을 때의 저해효과의 확인을 위해
[Table 4.] IC50 and interactions of Alcaligenes sp. with binary heavy metal treatments

IC50 and interactions of Alcaligenes sp. with binary heavy metal treatments
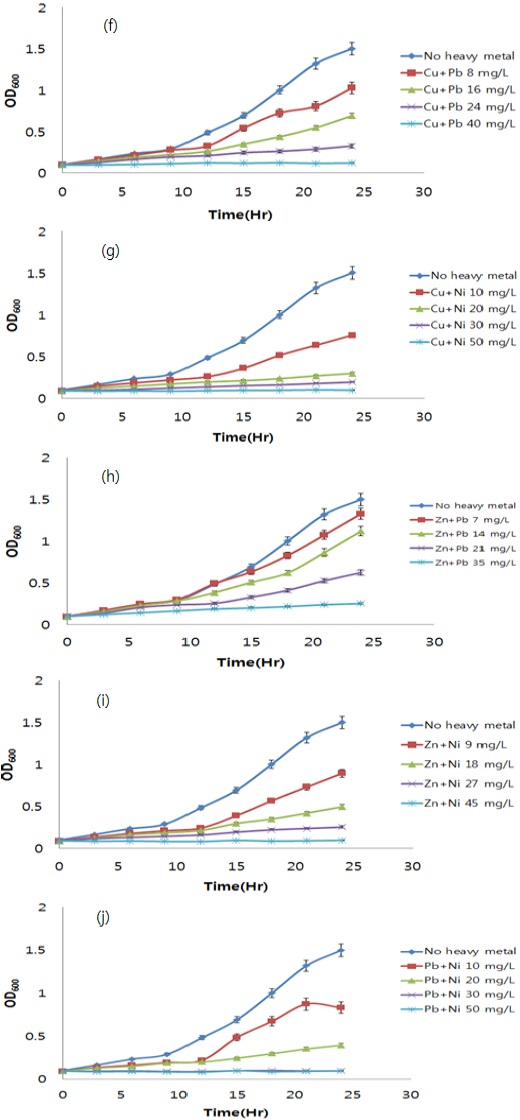
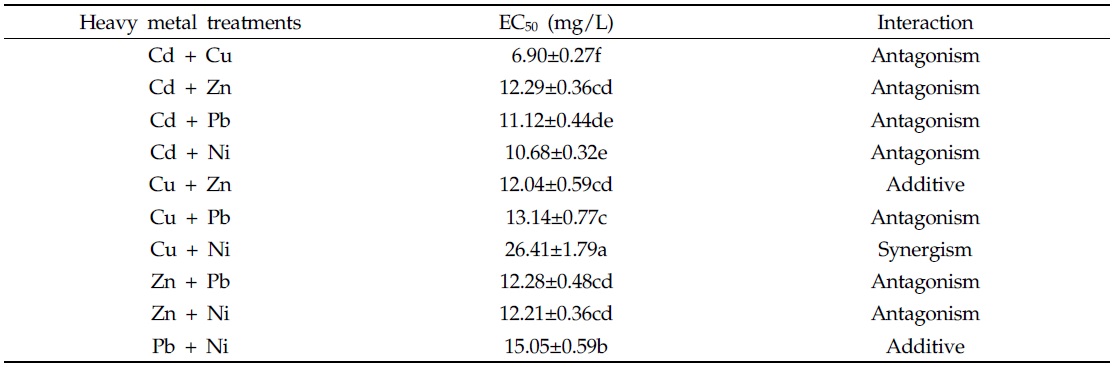
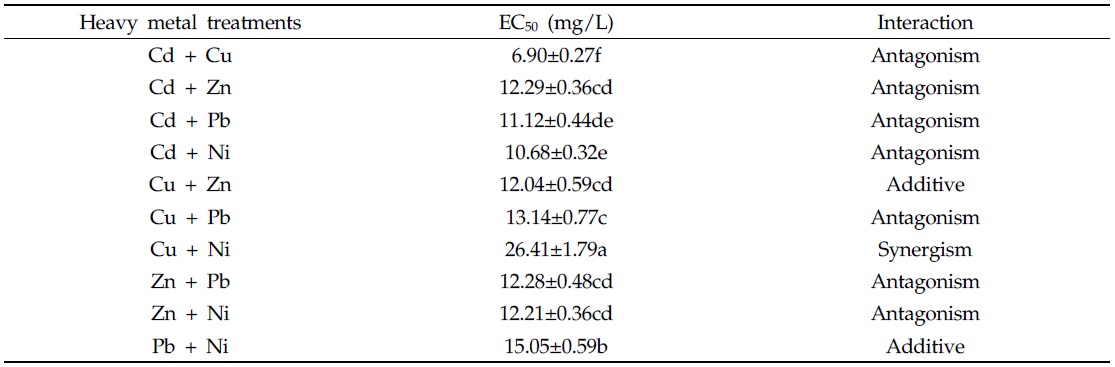
다음으로, 중금속 혼합 처리가 균주의 인 제거에 미치는 영향을 확인하기 위해 초기 인 농도와 최종 인 농도를 측정하였으며, 각각의 중금속 처리구 별 인 제거율은 Fig. 5 와 같다. 측정 결과, 인 제거효율은 중금속의 종류에 관계없이 처리한 중금속의 농도가 증가할수록 감소하는 경향을 보였다. 인 제거효율은 중금속을 처리하지 않은 대조구에서 가장 높았으며, 처리구별 인 제거 저해효과를 계산 후, 결과 값을 선형회귀 분석하여 인 제거반응이 절반이 되는 지점인 EC50을 추정하였다. 중금속 혼합 시, 교호작용의 판단은 위해 additive index value를 이용하였다(Table 5). EC50에 해당하는 농도가 가장 낮은 처리구는 Cd + Cu 처리구 였으며, 그 농도는 6.90 mg/L 이었다. 반면, EC50이 가장 높은 처리구는 Cu + Ni 처리구로, 그 농도는 26.41 mg/L 이었다. 중금속 간 교호작용 평가 결과, Cu + Ni 처리구는 상승효과(synergistic effect)를 보였으며, Cu + Zn, Pb + Ni 처리구에서는 상가효과(additive effect)를 보이는 것을 확인할 수 있었다. 이러한 결과는 2 종의 중금속 혼합 처리 시 중금속 간 교호작용은 대부분 상가적(additive) 또는 상승적 상호작용(synergistic interaction) 이라고 보고하였던 Buhl과 Hamilton(1997), Tao 등(1999) 의 연구보고와 상이하였다. 그러나, 독성의 연구에 활용한 bioassay의 method에 따라 혼합독성의 양상이 다르게 나타날 수 있으며, 실험 결과 중금속 간 상호작용이 길항효과(antagonistic effect) 로 나타난 결과가 더 많은 것은 생물학적 독성평가에서 일반적으로 사용하는 미생물(
[Table 5.] EC50 and interactions of Alcaligenes sp. with binary heavy metal treatments
EC50 and interactions of Alcaligenes sp. with binary heavy metal treatments